Neuron | 神经调控靶向胶质细胞清除Aβ以及神经保护策略
by 管理员 | 2024-01-31
北京时间1月30日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院詹阳研究员团队在Neuron杂志在线发表题为Clearance of β-amyloid and synapses by optogenetic depolarization of microglia is complement selective研究论文。

文章上线截图
点击文末“阅读原文”查看全文
小胶质细胞作为中枢神经免疫系统中的神经免疫细胞在发育、环境监视、神经突触功能和神经系统疾病中起着重要作用。在神经系统发育过程中,小胶质细胞通过调节突触生物分子和修剪神经突触来帮助塑造神经环路,通过其触手的伸缩不断感知周围环境变化,发挥监视作用。当中枢神经系统发生损伤时,小胶质细胞发挥吞噬作用,吞噬并消除微生物、死亡细胞碎片、蛋白质聚集体,以及可能危害中枢神经系统的可溶性抗原等。在某些特定的刺激或神经炎症情况下或当小胶质细胞功能失调时,其也有可能通过吞噬或分泌炎症因子等方式损伤和杀死神经元,影响神经退行性疾病例如阿尔茨海默病(AD)的发生与发展。
AD患者大脑中伴随β淀粉样蛋白(Aβ)和微管相关蛋白(Tau)聚集形成的具有毒性的寡聚物,抑制Aβ聚集或促进其清除,被认为是该病治疗的一个有效手段。目前已知小胶质细胞在Aβ聚集中发挥作用,但对于靶向动态调控小胶质细胞是否可以影响Aβ聚集及其同神经元之间的关联尚不明确。另一方面,传统的神经调控方法大多针对神经元进行操作,针对胶质细胞开展神经调控与内在调控机理的相关研究目前较少。
基于小胶质细胞和神经元之间的紧密关联及其在神经退行性疾病中的作用,研究团队成功建立了一套在体外和体内特异性去极化激活小胶质细胞的方法。通过光遗传方法激活小胶质细胞,发现小胶质细胞去极化可以促进脑实质中Aβ的清除,但同时也会增强神经突触的消除。研究团队进一步寻找了神经突触清除的关键机制,发现补体信号通路C1q可以选择性地防止小胶质细胞去极化诱导的突触损伤,但不影响Aβ清除。该研究给出了一种小胶质细胞靶向调控的有效方法,揭示了小胶质细胞介导的独立吞噬途径,给出了一种针对神经退行性疾病治疗的病理性蛋白清除和神经保护的协同策略。
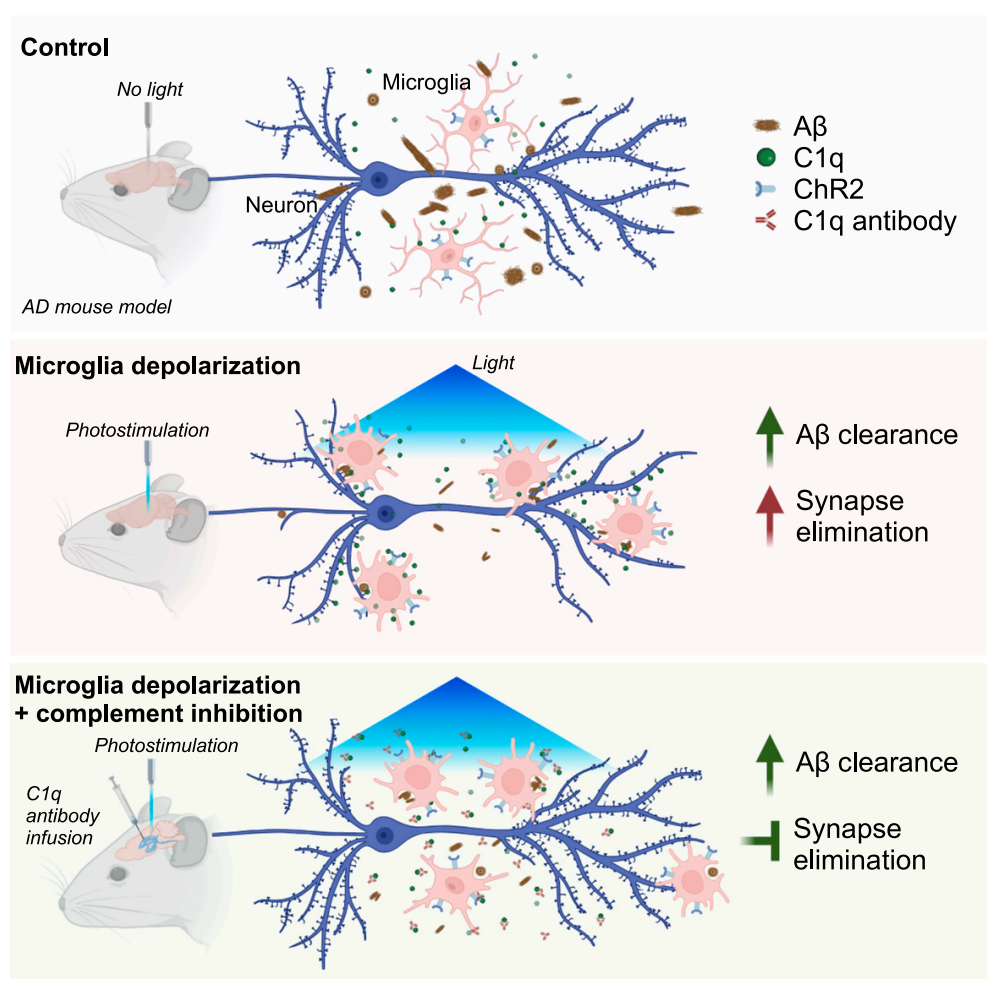
神经调控小胶质细胞清除Aβ和补体通路抑制保护神经突触
本研究中,首先在离体方面,研究团队成功将光感基因蛋白表达于小胶质细胞细胞系和原代细胞中,发现光遗传激活可以有效的使得细胞去极化,进而发现光刺激激活小胶质细胞后对Aβ以及突触小体(Synaptosomes)等物质的吞噬能力增强。采用来自AD病人组织毒性更强的Aβ蛋白,研究团队也发现光激活小胶质细胞可以增强Aβ吞噬。在体方面,研究团队应用小胶质细胞特异性小鼠(Cx3cr1-cre)和光遗传工具小鼠(Ai27)获得双转基因小鼠,发现光遗传激活小胶质细胞可以导致光照区域的细胞数量、形态发生明显变化,且不同时长的光遗传刺激带来小胶质细胞对神经突触的不同程度的包裹,刺激时间越长二者的共定位越多。同样的,在AD模型小鼠(5xFAD)中开展光遗传小胶质细胞调控也带来Aβ减少,并且导致突触蛋白(VGlut1、PSD95)以及突触突棘等下降。
接下来,研究团队通过针对抑制补体系统通路开展了神经保护研究。团队发现光遗传激活小胶质细胞导致神经突触丢失同时,补体通路分子C1q发生上调。进而团队通过抑制C1q,发现小胶质细胞光遗传激活不再吞噬神经突触。进一步在AD模型中,发现C1q抑制后,实现了光遗传激活小胶质细胞可以清除Aβ,但并不吞噬神经突触。因而,本研究提供了一种靶向小胶质细胞的调控策略,该方法可以有效减少神经退行性疾病中的毒性蛋白聚集体,而同时保留正常突触连接。

论文通讯作者詹阳(右一)论文第一作者吕泽中(左一)
深圳先进院脑所詹阳研究员为文章的通讯作者,博士生吕泽中为论文第一作者。本研究的合作者为瑞士洛桑大学Rosa C. Paolicelli教授,中山大学中山医学院李勃兴教授,北京大学深圳研究生院周强教授,中国科学院深圳先进技术研究院脑所洪伟副研究员和合成所李楠研究员,感谢合作者的大力支持。

詹阳课题组部分成员,论文通讯作者詹阳(左三)论文第一作者吕泽中(右一)
原文链接

