CELL丨深圳先进院路中华/戴辑/鲍进研究团队提出帕金森病新型神经调控疗法
by 管理员 | 2023-11-03

帕金森病是老年人群中最为常见的神经退行性疾病之一,全球有超过600万患者,而其中一半的病人在我国。左旋多巴是目前临床上最常用的帕金森病治疗药物,但该药物除去干预帕金森病累及的基底节多巴胺神经环路并恢复其功能以外,还非特异性地作用于全脑和全身所有其他多巴胺系统,缺乏选择性并因此引发多种副作用,因此亟需研发高度特异性的帕金森病治疗方法。
11月2日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所(以下简称“深圳先进院脑所”)/深港脑科学创新研究院(以下简称“深港脑院”)路中华/戴辑/鲍进团队在国际顶级学术期刊《细胞》上在线发表了题为Circuit-specificgene therapy reverses core symptoms in a primate Parkinson’s disease model的研究论文。
文章上线截图
研究报道了一种全新的基于逆向腺相关病毒(retrograde AAV)的神经调控策略,这一技术与现有左旋多巴和多巴胺受体激动剂相比的最大特点是可以实现对帕金森病累及的基底节神经环路的精准靶向干预,而不影响全脑全身任一其他多巴胺通路和系统,为帕金森病临床治疗提供了潜在的全新精准干预技术。
逆向AAV病毒介导的直接通路靶向神经调控
逆转帕金森运动症状示意图
帕金森病的病因是中脑黑质脑区多巴胺神经元的大量死亡,从而导致基底节运动控制中枢的两条关键神经通路:直接通路和间接通路的活动失调并表现为一系列以运动障碍为主的临床症状。其中直接通路中受多巴胺调控的关键节点是纹状体脑区表达D1型多巴胺受体的D1中棘神经元,这些神经元在运动控制中起到类似“油门”-即促进运动的作用;在帕金森病中这些神经元活动被长期抑制,是导致帕金森病运动症状的关键因素之一。
过往基于啮齿类动物模型的研究发现,只要特异性逆转D1中棘神经元的活动抑制,就可以起到治疗帕金森病运动症状的功效;但实现这一靶向调控需要使用经过遗传改造的,在D1中棘神经元中表达外源蛋白元件的转基因动物,这是在灵长类大脑特别是人脑中完全无法实施的技术策略。研究团队通过对这一技术瓶颈进行系统分析发现,如果想要在纹状体脑区中做到对直接通路的D1中棘神经元进行干预而不影响同一脑区中的间接通路D2中棘神经元(在运动控制中起到类似“刹车”的作用),可以利用这两类神经元的神经环路结构差异:即只有D1中棘神经元的轴突投射至远离纹状体的黑质网状部脑区,而D2中棘神经元的轴突投射至紧邻纹状体的外侧苍白球脑区。
基于这一特有环路结构差异,研究团队创新性地提出:将高效感染神经元轴突的逆向AAV病毒递送至黑质网状部,这些逆向AAV感染轴突并标记D1中棘神经元;而D2中棘神经元的轴突远在苍白球,因此在结构上杜绝了被标记的可能。这一D1中棘神经元靶向标记策略辅以化学遗传学介导的神经活动调控,即可在灵长类脑中对D1中棘神经元/直接通路进行选择性活动调控,从而实现对帕金森病运动症状的靶向干预。该技术创新的重要优势在于其在全脑所有多巴胺通路中,高度选择性地调控了基底节直接通路,而不会干扰全脑和全身其他多种多样的、且未受到帕金森病影响的多巴胺通路和相关功能,从而实现了疾病干预的高度靶向性。
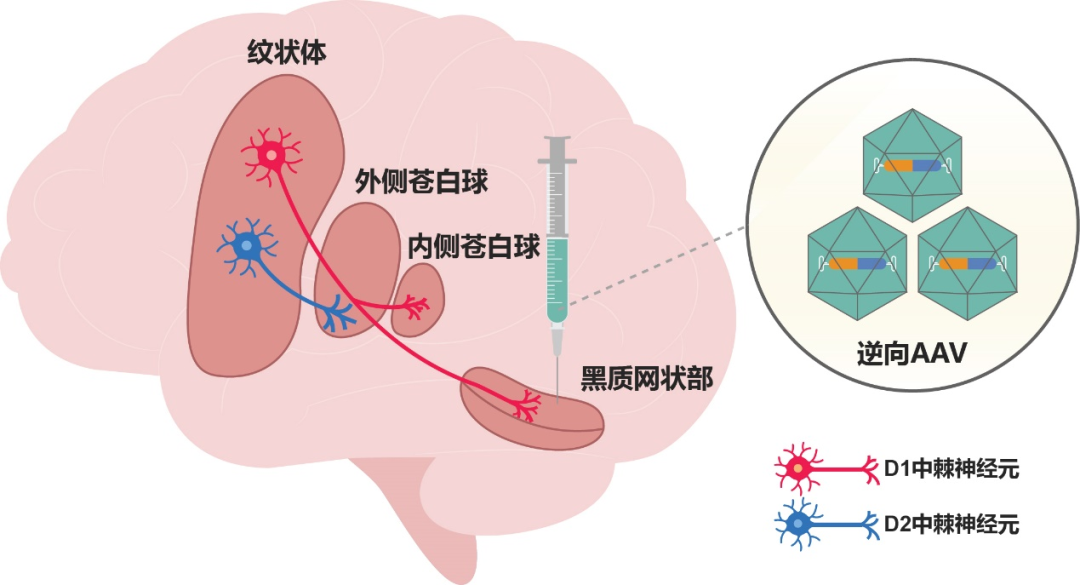
逆向AAV介导的帕金森病神经环路靶向神经调控策略
为实现上述策略,研究团队开发了高效逆向标记D1中棘神经元的全新AAV衣壳AAV8R12,以及驱动目标基因在中棘神经元广泛表达的全新启动子G88P2/3/7。与深圳先进院脑所和深港脑院的李翔研究员密切合作,团队筛选了化学遗传学元件rM3Ds以与全身系统给药相匹配。上述组件构成的神经调控体系不仅能在小鼠脑中,还能在猕猴脑中靶向激活D1中棘神经元/直接通路。

靶向标记策略高效标记猕猴纹状体脑区
接下来的动物实验发现,这一基于神经环路逆向示踪的神经调控策略在灵长类帕金森病模型中高效逆转了运动相关的疾病表型:相较于干预前,干预后动物的运动迟缓症状得到极大缓解,震颤表型基本去除,运动技巧也得到很大恢复。论文主要通讯作者(Lead Contact)、深圳先进院脑所脑编辑中心主任路中华研究员在描述这一崭新的靶向神经调控技术的疗效时说道:“令人振奋的是,对比现有的左旋多巴药物治疗,新技术表现出多个独有优势。第一,环路靶向神经调控起效更快。第二,环路靶向神经调控单次给药后药效维持至少24小时,而左旋多巴通常药效不超过6小时。第三,环路靶向神经调控在长期持续给药(超过8个月)后药效稳定且不会引发服用左旋多巴常见的副作用-异动症。”此外,左旋多巴需要帕金森病人有部分残余多巴胺神经元以将其转化为多巴胺,而环路靶向神经调控不依赖这一转化步骤,理论上为晚期丧失所有多巴胺神经元的帕金森病人提供了可行的全新干预策略。
研究团队现正积极开展该项技术的临床转化工作。值得关注的是,几乎所有的神经系统疾病都伴随着特定神经环路的功能异常,然而过往技术尚未实现在灵长类脑中对这些疾病累及的重要神经环路进行精准功能矫正以达到干预疾病表型的目的。本研究所建立的神经调控框架和技术体系为在灵长类脑中实现靶向干预疾病神经环路,并逆转疾病表型提供了重要范例。

论文通讯作者路中华(左三)、戴辑(左二)、鲍进(右三)与论文共同第一作者洪泽璇(右二) (林一程 摄)
该研究由中国科学院深圳先进技术研究院脑认知与脑疾病研究所、深港脑科学创新研究院路中华、戴辑、鲍进团队合作完成。路中华研究员是论文的主要通讯作者,戴辑副研究员和鲍进研究员为共同通讯作者。论文的第一作者是中国科学院深圳先进院脑所/深港脑院助理研究员陈晔菲博士,共同第一作者是深圳市妇幼保健院和中国科学院深圳先进院联合培养博士后洪泽璇博士。项目的合作方包括深圳市妇幼保健院李元涛教授课题组,徐州医科大学李安安教授课题组,南方医科大学姜晓丹教授,中国科学院上海药物所中科中山药物创新研究院陈迁研究员等。
专家点评
孙强 研究员
中国科学院脑科学与智能技术卓越创新中心
随着人口老龄化趋势的加剧,帕金森病 (PD)等神经系统疾病正在愈发严重威胁着人类的健康。临床上通常用左旋多巴或多巴胺受体激动剂治疗PD,但由于多巴胺受体分布广泛,该疗法缺乏特异性,长期使用后会导致严重的副作用。
在最新一期的Cell杂志文章中,路中华/戴辑/鲍进团队开发了一种新型的PD神经调控策略,可以选择性地操纵人工诱导PD动物模型脑内受损的神经环路,首次实现了针对PD病灶脑区的靶向神经调控。动物实验结果表明,该疗法不仅在PD小鼠模型中有效,在非人灵长类PD模型中同样有效。其在缓解模型动物如震颤和运动技能缺陷等PD症状方面比左旋多巴类药物更有效且更持久。鉴于该方法同时在小鼠和非人灵长类动物模型得到了验证,非常有望实现临床转化。
另,该工作在实施过程中层层递进,从rAAV载体设计开始就不断优化整个化学遗传学方案的各个技术环节,并最终实现了预期目标,充分体现了科学发现需要循序渐进和厚积薄发的特点。
曹鹏 研究员
北京生命科学研究所
帕金森病(PD)作为中老年的常见神经退行性疾病,影响着全球数百万患者,然而目前临床上治疗PD的方法仍然很有限。近年来在新方法的探索上有来一些进展,例如干细胞疗法,免疫疗法,甚至还有通过纳米材料来延缓帕金森病进程的尝试。相比这些已报道的方法,路中华/戴辑/鲍进团队所开发的新型PD疗法,基于逆向AAV特异性调控D1-MSN的策略,原理清晰,功能验证明确,并在PD猴上展示了令人赞叹的疗效。由于猴与人在PD病理上的相似性(猴也可自发患PD),该疗法具备了极高的临床转化可能。同时也看好该疗法在成本控制上相较其他验证中的方法(如免疫疗法)的优势,预测其具备更好的市场前景。
文章链接
https://doi.org/10.1021/acsami.3c07189

