Acta Biomaterialia|深圳先进院开发可用于体外三维神经网络构建和光遗传解析的新型水凝胶支架
by WANG Lab& LU Lab | 2022-12-19
中国科学院深圳先进技术研究院脑认知与脑疾病研究所(简称“深圳先进院脑所”)鲁艺研究员和王立平研究员团队开发了一种可用于体外三维神经网络构建的水凝胶支架,并以此为基础实现了对癫痫样波的精确诱导和光遗传干预。相关成果于2022年12月12日在线发表于知名学术期刊Acta Biomaterialia上(影响因子10.633)。

图1:文章上线截图(点击“阅读原文”可查看)
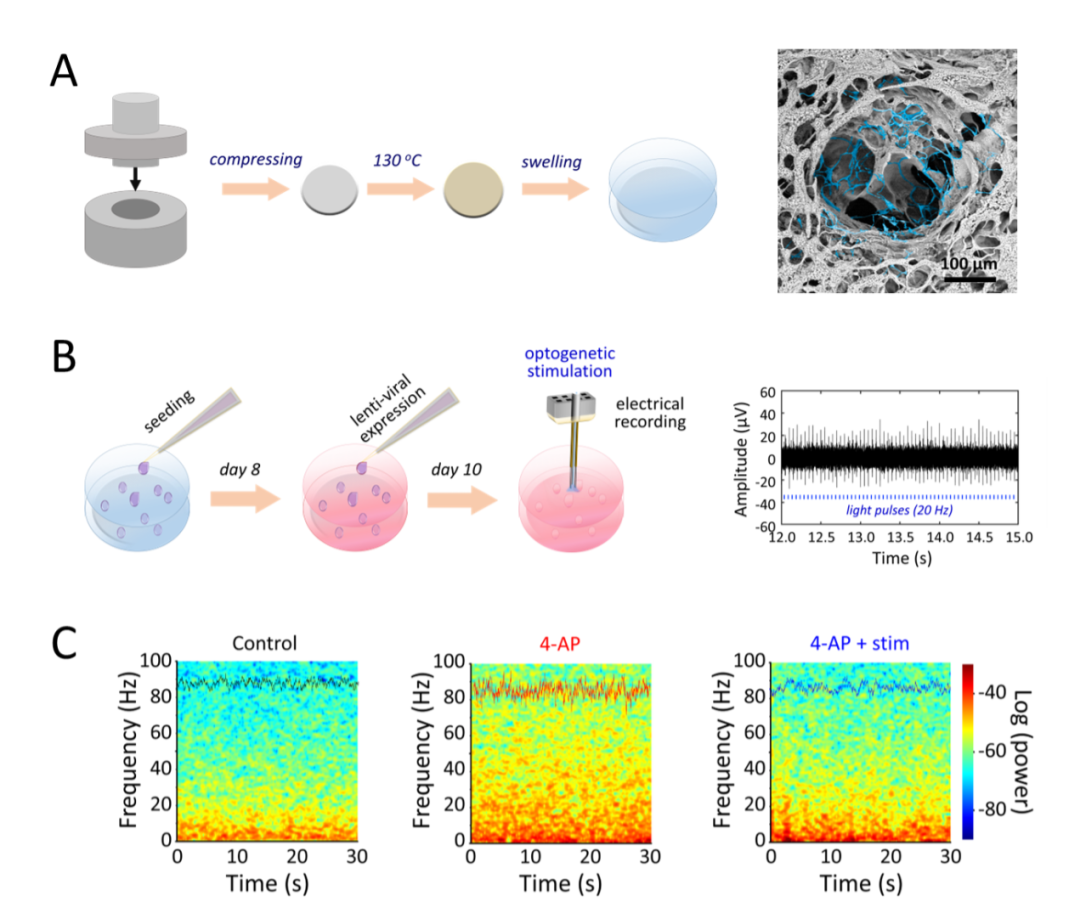
在本研究中,该团队将聚丙烯酸(PAA)、聚乙烯醇(PVA)和聚乙二醇(PEG)充分混合均匀后,于130℃下进行充分煅烧。在此过程中,熔融态的PEG可作为PAA的溶剂并显著促进其与PVA的酯化反应。同时,PEG亦部分参与了与PAA的酯化反应,并最终帮助形成了结构更加松散的聚合物结构。通过充分溶胀后得到的水凝胶支架具有较高的孔隙率(﹥90%)、贯通的孔隙连接和接近神经组织的力学性能(杨氏模量kPa量级),为神经组织的培养提供了一种理想的微环境(图A)。此外,溶胀后的水凝胶支架具有较高的透光性,可以实现对培养细胞的实时观察。得益于上述优点,研究人员在该水凝胶支架上实现了小鼠海马原代神经元的长期培养,以及体外三维神经网络的构建(如视频所示)。
随后,研究人员利用慢病毒载体,将光敏感蛋白表达在了体外培养的神经细胞上,并通过光电极阵列实现了对目标神经元的光遗传激活和电生理记录(图B),证实了体外三维培养的神经元细胞具有良好的活性。以此为基础,研究人员利用钾离子通道阻断剂4-AP,在体外培养的转基因小鼠(Vgat-ChR2 transgenic mice)海马原代神经细胞网络中成功诱导出了癫痫样波,并通过光遗传激活中间神经元,实现了对癫痫样波的精准抑制(图C)。上述结果证实了制备的水凝胶支架可用于体外长时程神经细胞培养和三维神经网络构建,并可结合光遗传学和电生理等技术对神经环路的功能实施精准化的解析。
近年来,鲁艺研究员团队通过与多个合作团队联合攻关,在植入式神经电极阵列技术(Advanced Materials, 10.1002/adma.202209324;Journal of Neural Engineering, 2022;19:016003;Small, 2021;2006612)和柔性光遗传技术(BMC Biology, 2021;19:252;Advanced Optical Materials, 2018;6:1800427)等方面取得了一系列进展,并借助自行研发的技术,对病理状态神经环路的功能进行了深入的解析(Cell Reports, 2022;41:111570;Nature Communications, 2016;7:10962)。在本工作中,研究者为疾病的研究构建一个简化的体外模型,为病理状态神经环路结构和功能的定量化解析提供新的可能性,同时也为从在体-离体多个层面深入理解复杂的大脑功能提供了愈加完善的技术支撑。
深圳先进院脑所的助理研究员阎梦萦博士和王璐璐博士为这项工作的共同第一作者,鲁艺研究员和王立平研究员为共同通讯作者。该研究受到了国家科技创新2030—“脑科学与类脑研究”重大项目、国家自然科学基金(优青、面上)、广东省杰青、广东省特支计划、中科院重点实验室等项目的资助。

