Neuron丨深港脑院王立平等团队发现骨源性激素—骨钙素作用经典奖赏中枢VTA启动逃跑反应(段树民/何舜平/蒋青点评)
本能恐惧反应,是物种进化中形成的核心生存策略。这种对潜在天敌的快速应对机制,对于保障个体生存与物种延续至关重要。这一行为的调控机制不仅涉及中枢环路,也关乎中枢与外周信号的复杂相互调控机制(Tseng YT. et. al. Nature Reviews Neuroscience,2023),其功能异常往往与多种精神疾病密切相关,包括焦虑症、抑郁症和创伤后应激障碍等。因此,深入解析本能恐惧行为的脑体互作机制,不仅能揭示跨器官的功能协同调控物种生存行为的生物学本质,更为神经系统与其他器官共病的临床干预提供全新思路,还有望为生物启发的具身智能体开发提供新的洞见。
王立平研究员团队长期致力于本能行为的神经环路解析,以及中枢外周互作对机体稳态的调控机制和转化研究。团队通过神经环路示踪、光/药物遗传学、电生理、3D精细行为学、多组学等交叉前沿方法,围绕本能行为神经环路基础以及脑体互作调控机体稳态的机制这一核心科学问题,取得了一系列系统的、原创性研究成果,累计发表高水平学术论文130余篇,包括Neuron (7篇)、Nature Communications(6篇)等,并受邀在Nature Reviews Neuroscience、Neuron 等撰写综述论文。
2月11日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院、深圳理工大学王立平研究员、刘雪梅副研究员、李翔研究员、谭力铭研究员团队通力合作,在Neuron杂志上在线发表题为“A bone-derived hormone permits rapid visual escape via GPR37 receptor in a subpopulation of VTA GABAergic neurons”的研究论文,该研究首次揭示:骨骼释放的激素骨钙素(Osteocalcin, OCN)能够激活大脑腹侧被盖区(VTA)内共释放GABA与谷氨酸的神经元中表达的GPR37受体,通过cAMP-THIK-1这一非经典信号通路迅速增强此类神经元的兴奋性,进而驱动在急性天敌应激的快速逃跑反应。

文章上线截图
模拟捕食者逼近的“视觉阴影刺激”(Looming)是研究本能恐惧反应的经典范式。王立平研究员团队于2015年在国际上率先证明了上丘到丘脑枕核到杏仁核的皮层下通路的结构的存在并处理视觉本能恐惧的新功能,回答了神经科学领域长达数十年的争议问题,文章至今被引用411次(Wei PF et al., Nature Communications, 2015);随后,进一步揭示了传统奖赏中枢——腹侧被盖区(VTA) 的特定GABA能神经元,是驱动快速逃跑行为的关键中继站,文章至今被引用达206次(Zhou Z & Liu XM et al., Neuron, 2019)。团队最新研究发现,急性天敌应激的恐惧反应存在个体差异,在恐惧高敏感个体中,这群VTA神经元会持续接收来自上丘的输入并输出到恐惧中枢杏仁核,维持一种持续的警觉状态(Liu XM et al., Neuron, 2025)。
然而,一个核心的基础性问题依然存在:机体中何种来自外周器官的信号能预先调控这些VTA的特定类型神经元功能状态,使其维持在高度警觉的"预备状态"(Permissive state),从而保障天敌来临时的快速逃跑反应? 这一关键核心问题的回答,在很大程度上将帮助我们深刻理解机体整体层次上器官间信息传递如何调控个体生存能力的底层科学逻辑。
在应激反应中,经典的外周激素如皮质酮、肾上腺素与等虽扮演关键角色,但传统研究往往聚焦于中枢神经机制,或关注这些激素对心率、血压等外周指标的快速影响,急性应激下尤其是机体面对生死攸关的天敌应激下,外周其他器官的调控信号如何重塑“体-脑”联动机制缺乏系统阐释。
近年来,骨骼作为内分泌器官的作用逐渐被重视。从进化角度看,骨骼不仅保护大脑,其与神经系统的协同进化也帮助生物应对环境挑战——例如中国科学院水生所何舜平、王文教授研究团队证明脊椎动物在从水生向陆地过渡的宏大演化历程中,与应激、焦虑相关的基因发生了显著变化。这表明,“登陆”这一重大环境剧变,可能在遗传层面筛选并强化了更具警觉性的个体,以应对陆地上更加未知且多变的危险(Wang K et al.,Cell, 2021)。骨骼分泌的骨钙素(OCN)已被证明在能量代谢、糖脂稳态等方面具有重要作用,但其能否作为急性应激信号、通过特定脑区、细胞、特定分子调控机制,连接骨骼与大脑、代谢与行为,在危急时刻启动逃跑反应,还是未解之谜。
研究发现,Looming反应可显著提升血液OCN水平;老年鼠OCN下调伴随应激反应敏感性降低,OCN敲除小鼠得到类似结果,证实OCN参与该反应。VTA脑区补充OCN实验表明VTA是OCN发挥作用的关键脑区(图1)。在OCN受体研究中,通过敲除模型证明GPR37介导逃跑反应,且VTA的GABA能与谷氨酸能神经元上的GPR37起主要作用(图1)。电生理实验显示OCN通过调控VTA神经元钾电流影响神经元活性。单细胞测序与机器学习分析表明GPR37与钾通道THIK1、GPR158与GIRK1分别相关;π-FISH技术进一步证实GPR37与THIK1共表达于Type I神经元,GPR158与GIRK1共表达于Type II神经元(图2)。功能上,OCN通过GPR37抑制THIK1电流增强兴奋性,通过GPR158增强GIRK1电流导致抑制。机制上,GPR37通过非经典Gi通路降低cAMP、抑制THIK1通道,从而提升神经元兴奋性。行为学实验验证,VTA区阻断cAMP或特异性敲除THIK1通道均会削弱逃跑反应(图2)。
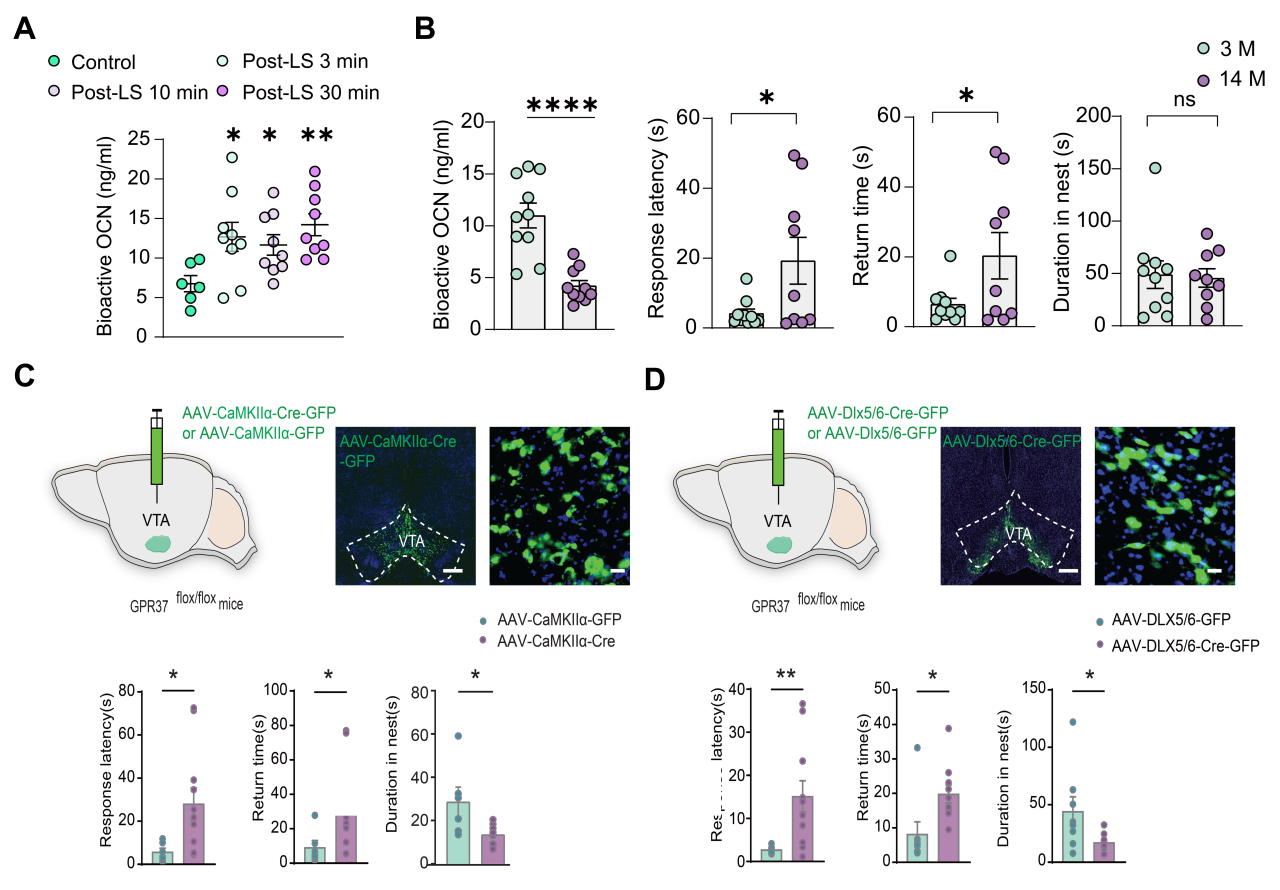
图1. OCN通过调控VTA脑区GABA能以及谷氨酸能神经元调控本能逃跑反应
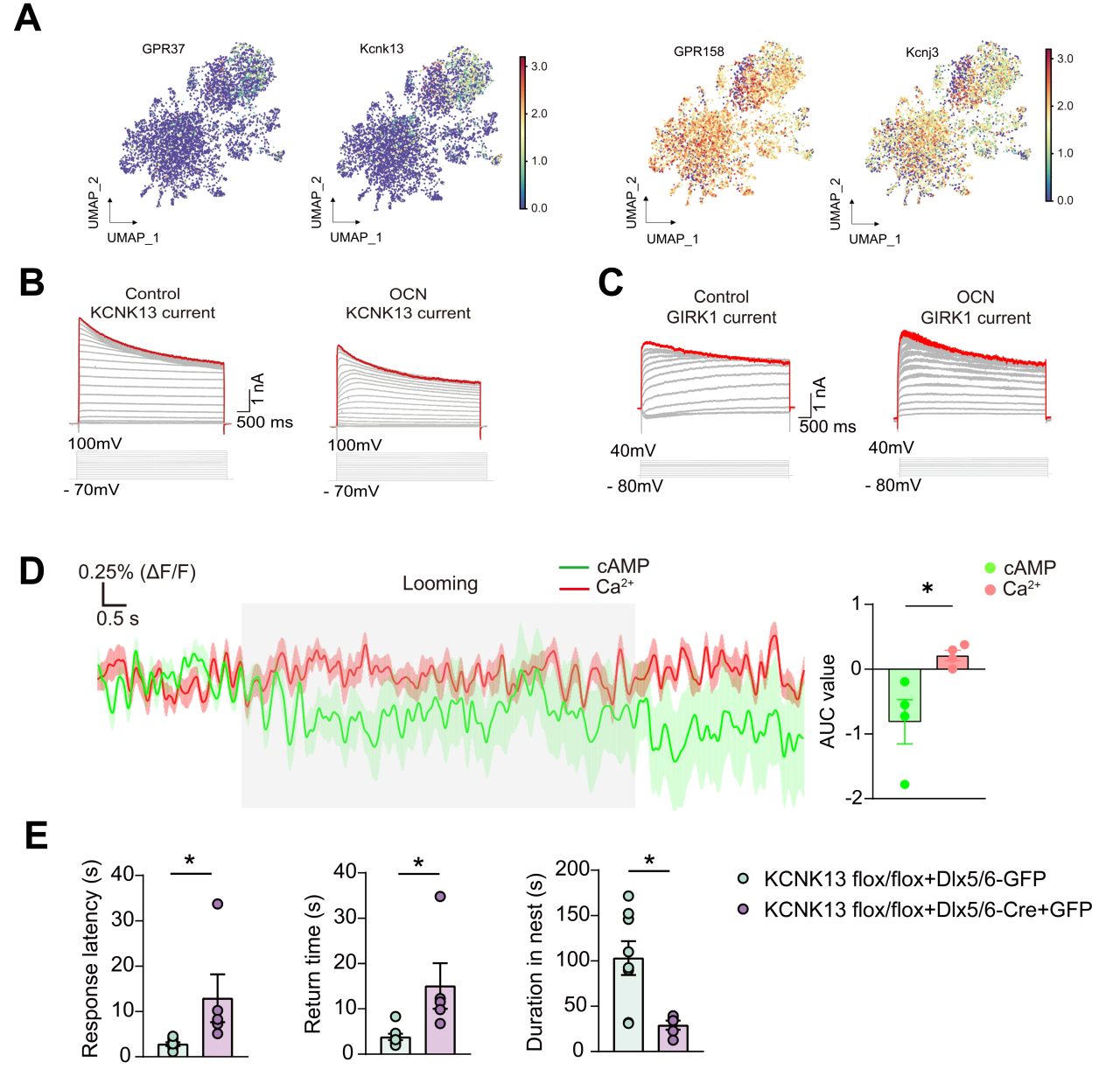
图2. OCN通过激活GPR37抑制cAMP水平和KCNK13通道介导本能逃跑反应
综上,本研究揭示了骨骼激素OCN在危急时刻启动本能逃跑反应的完整通路:OCN → 结合VTA GABA-Glu共释放的神经元上的GPR37 →降低cAMP→抑制THIK1钾通道→ 增强神经元兴奋性→ 触发快速逃跑行为。
该研究首次揭示了骨骼作为内分泌器官,通过分泌OCN调控中脑神经环路功能的全新机制,建立了“骨-脑轴”与生存行为调控的直接关联(图3)。这一发现不仅拓展了对跨器官协作调控神经行为的认知边界,更为骨质疏松共患抑郁、神经退行性疾病等跨系统疾病的治疗提供了新的干预靶点和视角。
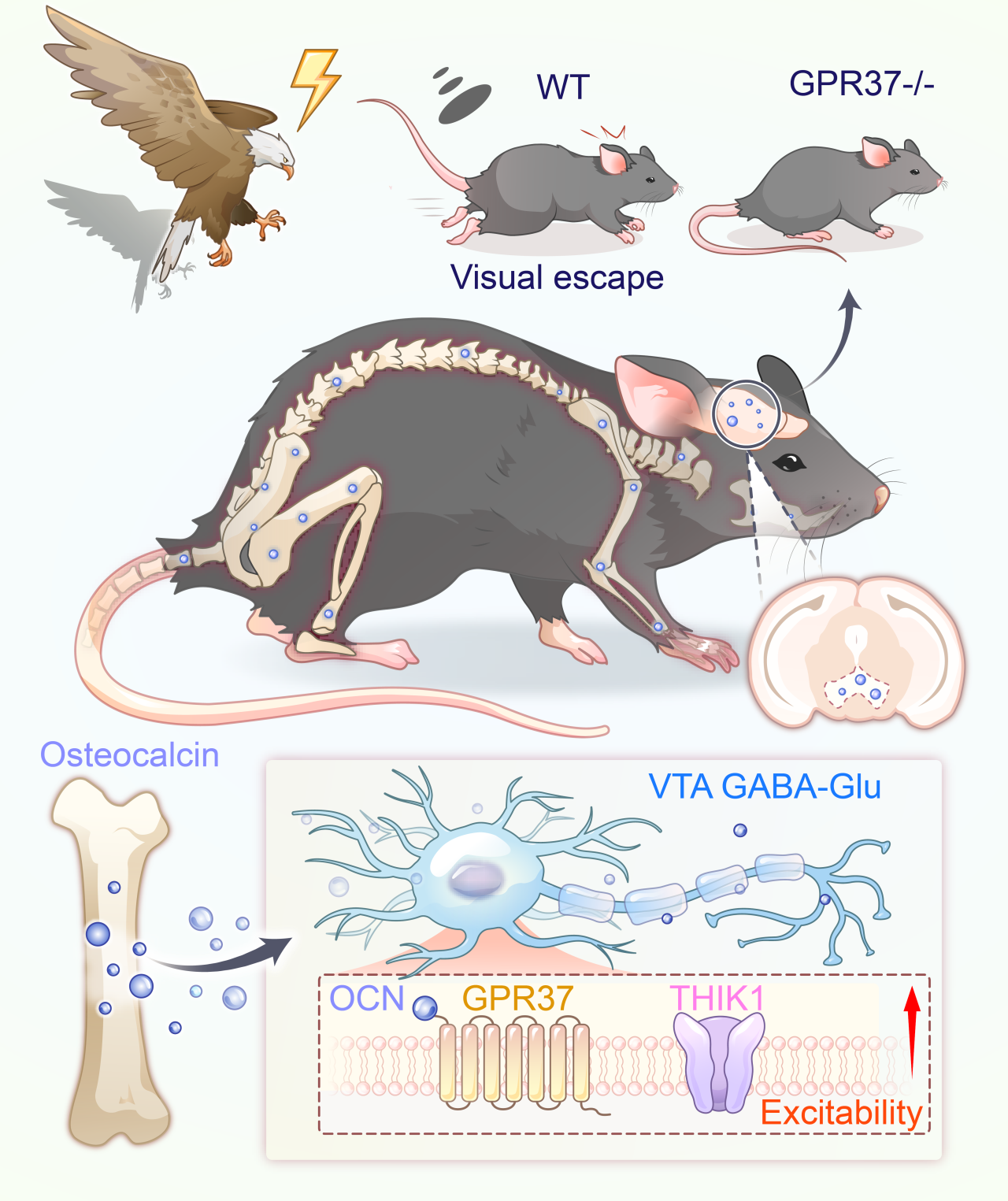
图3. “骨-脑轴”与生存行为调控研究示意图
中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院王立平研究员为本文最后通讯作者,刘雪梅副研究员、谭力铭研究员、李翔研究员为本文共同通讯作者,刘雪梅副研究员、博士后王帅毓、助理研究员赖娟为论文共同第一作者。该研究得到了四川大学华西医院蒋若天研究员、深圳先进院储军研究员的大力支持和帮助,研究也得到了深圳理工大学Helmut Kettenmann教授、韩明虎教授以及中国科技大学/先进院毕国强教授的指导。感谢科技创新2030“脑科学与类脑研究”重大项目、国自然重点项目、广东省卓越创新团队、广东省脑连接图谱重点实验室、深圳杰出人才项目、深圳神经精神调控工程重点实验室等基金对本研究的支持。感谢深圳市脑解析与脑模拟重大科技基础设施提供的设备与技术支持。
段树民(中国科学院院士)评价:
这项研究重塑了我们对经典奖赏中枢腹侧被盖区(VTA)功能的理解。传统上,VTA主要被认为是大脑的“奖赏中枢”,编码动机、奖赏和快感。然而,王立平研究员团队前期的研究已经揭示,VTA的GABA能神经元是驱动快速逃跑行为的关键节点。本研究则进一步回答了更基本的问题:一个在进化上负责处理“趋利”(奖赏)的脑区,其防御性“避害”功能如何被精准且快速地启动?有意思的是,本研究发现了一种来自骨骼的特异性外周信号——骨钙素(OCN),充当了连接“骨骼警报”与“大脑防御程序”的钥匙。OCN并非广泛激活VTA,而是特异性作用于一类共释放GABA与谷氨酸的神经元亚群,通过其上的GPR37受体,将传统的抑制性Gi通路“改造”为产生兴奋性输出的非经典路径(降低cAMP → 抑制THIK-1钾通道)。从进化角度看,这一发现提示,在应对生存危机时,大脑并非孤立作战,而是接收来自身体-骨骼发出的优先级信号,而VTA接受这一信号后,为快速发动机体的防御行为提供了必要的动机。这为“体感-情绪-行为”的整合提供了一个外周锚点,即 “骨-脑轴”。本研究提示,VTA应被视为一个整合内外状态(代谢、激素)与生存价值(奖赏/威胁)的高级枢纽,而不仅是奖赏中枢。机体的内在状态(如骨骼释放的激素水平)能直接、快速地重塑特定神经环路的兴奋性,从而决定行为输出的阈值。这为理解焦虑、创伤后应激障碍等疾病中“警觉阈”的失调提供了全新的机制框架,为未来研究代谢疾病与精神疾病共病、应激相关障碍的干预,提供了新靶点和新思路。
何舜平(中国科学院院士)评价:
这项发现令人极为振奋,它为我们理解生命在重大环境变迁中的适应性进化,提供了一个前所未有的、具象化的生理学剧本。我们此前的研究表明,脊椎动物在四亿年前从水域向陆地的“登陆”过程中,经历了一场深刻的“压力筛选”。陆地的环境充满不可预知的危险,自然选择因此青睐那些警觉性更高、反应更迅速的个体,这在其应激与焦虑相关基因的演化上留下了烙印(Wang K et al., Cell, 2021)。然而,一个悬而未决的核心问题是:这种被写入基因的“警觉性”,在面临天敌的瞬间,究竟通过怎样的生理通路被快速启动并转化为求生行为?
王立平研究员团队的这项关于骨钙素(OCN)的工作,给出了一个优美而有力的答案。它首次揭示,骨骼——这个在进化史上为大脑提供物理保护的器官——本身就是一个快速的危机信号发射器。OCN不再仅仅是代谢调节者,而是在生死关头,从骨骼直接向大脑动机与行动核心(VTA)发送“逃跑”指令的第一信使。其机制的精致性尤为引人注目:它精准地作用于VTA中一类共释放GABA与谷氨酸的神经元,通过GPR37受体及下游的非经典cAMP-THIK-1通路,迅速调整神经元兴奋性。这完美解释了在进化压力下,机体如何实现“毫秒级”的体脑对话与行为动员。这不仅是“骨脑轴”概念从代谢领域向生存本能领域的革命性拓展,更是对“应激反应”理论框架的重要补充。
从进化视角看,这项发现意味着,骨骼与神经系统的协同进化,远比我们想象的更为深刻。它不仅是结构上的守护,更是功能上的整合与共谋。这项研究将基因演化的线索、器官间的对话、神经环路的调控以及最终的行为输出,串联成一个完整的故事,生动阐释了“登陆”所塑造的警觉性表型,其背后的即时生理执行机制。它为理解应激相关精神疾病的个体易感性,以及发展针对过度警觉或反应迟钝等不同表型的精准干预策略,开辟了极具前景的新方向。这项工作是跨学科研究的典范,它连接了进化生物学、骨骼内分泌学与系统神经科学,其洞察力将启发该领域未来的许多探索。
蒋青(南京大学)评价:
骨骼除了具有运动、保护、支撑等功能外,同样也可通过骨源性因子介导的内分泌功能参与机体其他器官稳态调控(Cell Metabolism,2024)。然而,从生物进化视角看,骨骼为何能广泛参与肌肉运动、能量代谢、生殖、记忆等功能调节?一种可能的解释是,骨骼在进化中不仅成为身体的机械支架,更成为促进脊椎动物在野外生存的适应性结构——其既能通过物理屏障保护内脏、辅助听觉与空间定位以侦测危险,也能通过增强记忆、优化肌肉功能与运动协调性,这些为有效躲避威胁提供基础。因此提示:骨骼或许具备调节危险应激与逃避行为的潜能,但其内在的分子与神经机制尚不清楚。中国科学院深圳先进技术研究院王立平教授近期在《Neuron》发表的题为:“A bone-derived hormone permits rapid visual escape via GPR37 receptor in a subpopulation of VTA GABAergic neurons”的突破性研究,系统阐明了骨源性因子骨钙素(Osteocalcin,OCN)在急性天敌应激下调控本能视觉逃跑行为的神经内分泌机制。该工作不仅确立了骨骼内分泌功能在急性应激反应中的核心地位,也深化了我们对“骨脑轴”在恐惧调控中作用的理解。
既往研究表明,急性应激可显著提升血液中OCN水平,且OCN能通过抑制外周副交感神经参与应激反应(Cell Metabolism, 2019)。然而,OCN是否调节应激相关的本能逃跑行为尚不清楚。王立平教授团队通过构建OCN敲除小鼠,首次证明OCN可通过与中枢神经元表面的GPR37受体结合,特异性增强腹侧被盖区(VTA)内一类γ氨基丁酸能神经元的兴奋性,从而驱动快速的视觉逃避行为。进一步的遗传学实验表明,无论是敲除OCN或GPR37,还是在VTA的GABA能或谷氨酸能神经元中条件性敲除GPR37,均会显著延迟小鼠的应激逃跑反应;而向VTA局部补充OCN或恢复GPR37信号则能挽救这一表型。机制方面,结合单细胞转录组测序与电生理记录,研究者揭示OCN经由GPR37降低细胞内环磷酸腺苷(cAMP)水平,进而抑制THIK-1钾离子通道电流,最终提升神经元兴奋性,促进逃跑行为。
值得注意的是,OCN的神经调节模式不同于多巴胺等经典神经递质。VTA神经元可在毫秒级时间内响应威胁刺激(Neuron,2010; Cell,2015),而源于骨骼的OCN必须穿越血脑屏障才能进入脑内,因此在危机初始瞬间,脑内OCN水平无法迅速升高。而王立平教授团队证明:OCN并非在应激瞬间“主动”触发神经元活动,而是通过维持VTA特定GABA能神经元亚群的基础高兴奋性,使其处于“预备状态”,从而保证个体在视觉危险信号出现时能即刻启动逃跑程序。该项研究首次揭示了骨源性激素OCN在危急情境下调控本能逃跑行为的完整通路,极大拓展了骨骼作为内分泌器官在机体应激与行为调控中的功能内涵,推动了骨脑交互研究从基础向临床转化,也为未来开发针对恐惧相关精神疾病的“脑体”多靶点干预策略提供了新思路。
参考文献:
- Xuemei Liu#*, Juan Lai#, Chuanliang Han#, Hao Zhong, Kang Huang, Yuanming Liu, Xutao Zhu, Pengfei Wei, Liming Tan, Fuqiang Xu, Liping Wang*. Neural Circuit Underlying Individual differences in Visual Escape Habituation. Neuron. (2025) Jul 23;113(14):2344-2357.e5.
- Xuemei Liu#*, Shuaiyu Wang#, Juan Lai#, Xiang Gao, Lina Wang, Bo Feng, Liang Yang, Zhengjiang Qian, Ruotian Jiang, Jun Chu, Liming Tan*, Xiang Li*,Liping Wang*. A bone-derived hormone permits rapid visual escape via GPR37 receptor in a subpopulation of VTA GABAergic neurons. Neuron. (2026)
- Zheng Zhou#, Xuemei Liu#, Shanping Chen, Zhijian Zhang, Yuanming Liu, Quentin Montardy, Yongqiang Tang, Pengfei Wei, Nan Liu, Lei Li, Ru Song, Juan Lai, Xiaobin He, Chen Chen, Guoqiang Bi, Guoping Feng, Fuqiang Xu*, Liping Wang*. A VTA GABA neural circuit mediates a visually evoked innate defensive responses. Neuron (2019) 103(3):473-488.e6. 18.68
- Pengfei Wei#, Nan Liu#, Zhijian Zhang#, Xuemei Liu, Yongqiang Tang, Xiaobin He, Bifeng Wu, Zheng Zhou,Yaohan Liu, Juan Li, Yi Zhang, Xuanyi Zhou, Lin Xu, Lin Chen, Guoqiang Bi, Xintian Hu, Fuqiang Xu, Liping Wang*. Processing of visually evoked innate fear by a non-canonical thalamic pathway. Nature Communications (2015). 6:6756
- Wang K, Wang J, Zhu C, Yang L, Ren Y, Ruan J, Fan G, Hu J, Xu W, Bi X, Zhu Y, Song Y, Chen H, Ma T, Zhao R, Jiang H, Zhang B, Feng C, Yuan Y, Gan X, Li Y, Zeng H, Liu Q, Zhang Y, Shao F, Hao S, Zhang H, Xu X, Liu X, Wang D, Zhu M, Zhang G, Zhao W, Qiu Q, He S, Wang W. African lungfish genome sheds light on the vertebrate water-to-land transition. Cell. 2021 Mar 4;184(5):1362-1376.e18.
