Cell | 深港脑院路中华团队突破AAV大载荷高效递送技术,开启大片段基因治疗新篇章
基因治疗是针对遗传和非遗传性疾病的重要干预策略。腺相关病毒(adeno-associated virus,AAV)因其低免疫原性和高安全性被广泛应用于基因治疗的基础研究和临床转化中的基因递送。然而,其约4.7 kb的包装上限将大量疾病相关的长基因载荷拒之门外。例如,众多孤独症和癫痫致病基因的大小都超越了AAV的包装容量限制,无法使用单个AAV病毒实现有效递送和基因治疗。现有的双AAV或多AAV策略往往存在重组效率低、截断蛋白表达多、治疗效果不稳定等问题,严重限制了其转化应用。
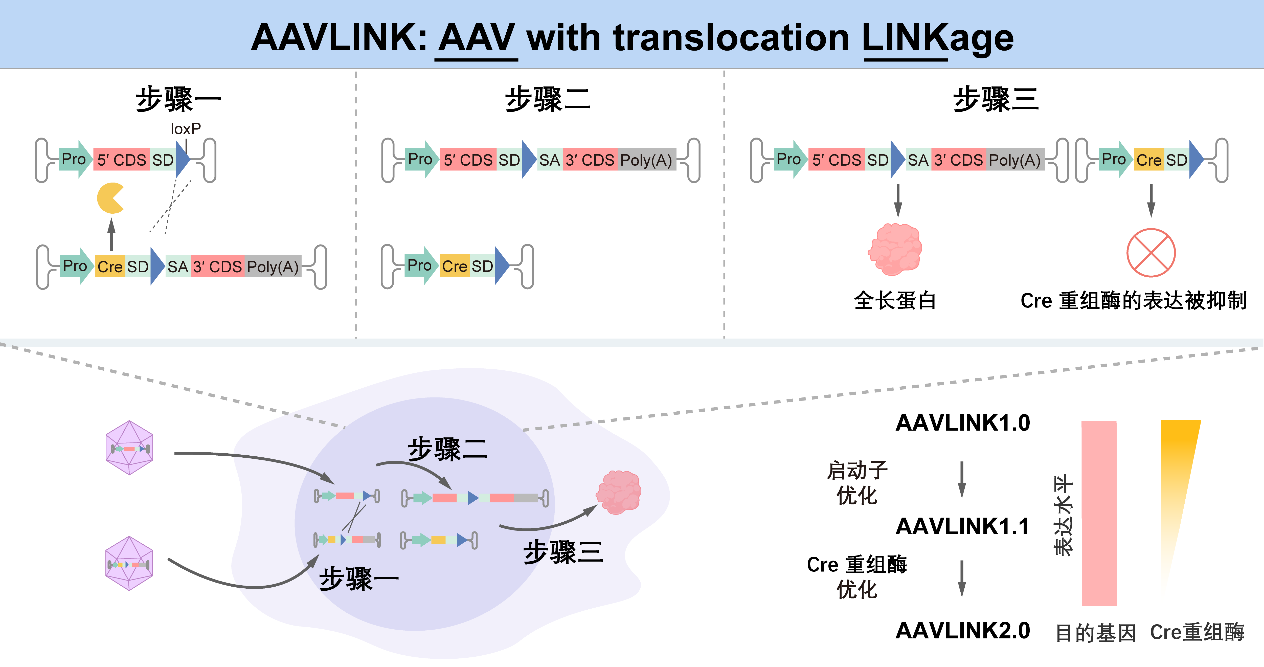
1月27日,一则发表于《细胞》的最新研究提出了解决AAV长基因载荷递送挑战的新技术。在本研究中,中国科学院深圳先进技术研究院/深港脑科学创新研究院路中华研究员和北京大学第一医院姜玉武教授研究团队(以下简称“研究团队“)合作开发了名为AAV with translocation LINK age(AAVLINK)的策略,利用Cre/lox介导的分子间DNA重组,在体内实现分段基因的高效、精准重构。与传统方法相比,AAVLINK在基因分割设计上具有更高灵活性,在靶组织中展现出稳定而高效的全长基因重建能力,并显著降低了异常截断蛋白的产生。


文章上线截图
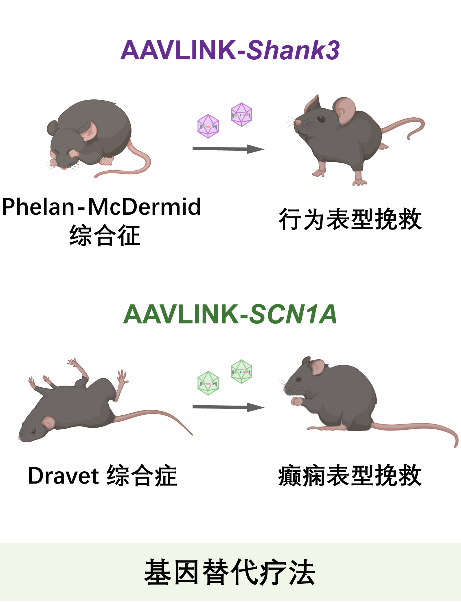
在模式动物中的功能验证实验显示,AAVLINK能够在体内成功重构并表达完整的孤独症致病基因Shank3和癫痫致病基因SCN1A,分别有效改善了Shank3缺失小鼠的孤独症样行为表型,以及Scn1a突变小鼠的癫痫发作症状,为复杂神经系统疾病的基因治疗提供了有力的概念验证。


在安全性方面,研究人员进一步研发了AAVLINK2.0版本,引入易降解的Cre(destabilized Cre),解决了重组酶长期留存体内可能引发的生物安全风险,提升了该技术向临床转化的可行性。

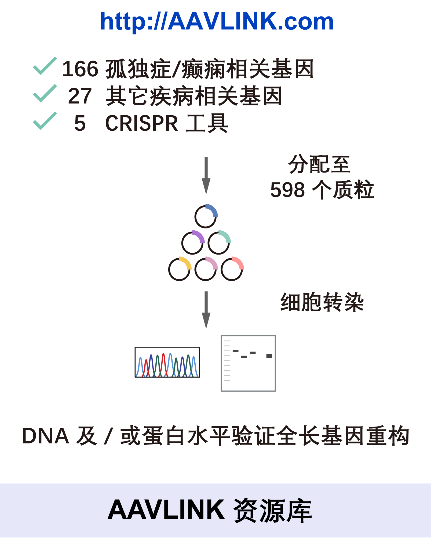
值得一提的是,研究人员基于AAVLINK技术构建了一个载体资源库,覆盖193个与孤独症,癫痫等疾病相关的长基因,以及5种CRISPR基因编辑工具,并系统验证了其基因重构能力。这意味着,AAVLINK不仅是一个单一的工具,更是一个可以大规模应用的通用型平台。
总体而言,本研究建立了一种高效、易扩展的长基因载荷AAV递送新范式,为相关疾病的基因治疗提供了新的技术策略,有望显著推动孤独症、癫痫等神经系统疾病及其他遗传病的基因治疗技术的临床应用。
该研究由中国科学院深圳先进技术研究院和北京大学第一医院研究团队合作完成。中国科学院深圳先进技术研究院生物医学与健康工程研究所、医学影像技术与系统全国重点实验室、深港脑科学创新研究院路中华研究员、北京大学第一医院儿童医学中心姜玉武教授、中国科学院深圳先进技术研究院生物医学与健康工程研究所刘太安副研究员是论文共同通讯作者。中国科学院大学博士研究生林剑邦、林韵萍,北京大学第一医院儿童医学中心刘娜娜博士是论文共同第一作者。
专家点评
冯国平(美国国家科学院院士、分子神经生物学家、美国麻省理工学院讲席教授)
基因治疗是疾病干预方法开发的重要前沿方向,而使用递送载体,如AAV等,实现治疗基因的高效递送是基因治疗的关键挑战之一。本项研究开发的AAVLINK技术实现了将最长超过11kb的完整功能基因载荷(如SHANK3,SCN1A,DMD等)高效递送至靶细胞,突破了长基因递送的关键技术瓶颈,为基因治疗的基础和转化研究提供了重要的创新技术。
作为应用示范,本研究聚焦了两种由单基因突变导致的发育性脑疾病。在孤独症致病基因Shank3突变小鼠中,通过向脑内递送全长为5.4kb的Shank3基因,逆转了动物模型的刻板样行为与运动相关缺陷。在Scn1a单倍剂量不足的癫痫动物模型中,系统性递送全长超过6kb的SCN1A基因,不仅改善了动物生存率与癫痫发作阈值,更在细胞水平恢复了海马神经元的正常电生理功能特征。这实现了从基因、细胞到整体行为的多层次表型挽救,为开发和在体验证基因治疗策略的安全性和有效性提供了的全新的技术范式。此外,该技术还能高效递送如碱基编辑器、转录调控器等基因长度超过单个AAV携载上限的CRISPR工具,拓展了在复杂神经环路中进行时空特异性基因组以及表观基因组操控的能力。值得关注的是,该技术在非人灵长类中枢神经系统中进行了成功的应用验证,为推动其在基础和临床前研究中的应用提供了范例。综上,AAVLINK是一个能够有力推动在体神经机制研究与脑疾病干预研究的新颖高效平台性技术。
高光坪(美国马萨诸塞大学Chan医学院Horae基因治疗中心教授)
腺相关病毒(adeno-associated virus, AAV)是目前基因治疗中应用最为广泛的递送载体之一,然而其基因组大小仅为~4.7 kb,限制了长基因载荷的递送。本研究开发的AAVLINK技术,在解决AAV载体包装容量限制这一技术瓶颈上取得了关键突破。其核心机制为利用Cre/lox系统实现了分开递送的AAV基因组之间的高效、位点特异性重组。与依赖转录后剪接或翻译后组装的传统策略相比,该技术在DNA层面上完成了全长基因的精确重构,而未重构的基因片段则不具备支持其表达的完整顺式作用功能元件。这是其重组效率显著优于现有方法(如intein系统)且几乎不产生截短蛋白的核心分子基础之一。研究团队通过一系列优化,系统性提升了该技术的临床转化潜力:采用不对称突变lox位点(如loxJT15/JTZ17)实现重组不可逆性;开发AAVLINK2.0版本,通过弱启动子(SCP1)与蛋白降解标签(UDeg3a)的组合,将Cre蛋白表达降至极低水平,显著降低Cre蛋白过表达引发的潜在毒性风险。
此外,该工作的另一个重要贡献体现在对该技术的系统性验证及平台化体系构建上。该研究不仅利用报告基因验证了技术原理,更在两个具有明确临床需求的疾病模型:Phelan-McDermid综合征(致病基因为SHANK3)和Dravet综合征(致病基因为SCN1A)中,证实AAVLINK递送全长治疗基因可有效逆转小鼠模型的表型缺陷。尤为重要的是,作者构建并验证了包含193个疾病相关长基因的AAVLINK载体资源库,为快速开发针对相应基因缺陷引发的遗传病的基因替代疗法提供了标准化工具与预制载体组件,在扩展AAV载体在基因治疗研发中的适用性具有重大意义。
