Biosensors and Bioelectronics丨深圳先进院脑所/深港脑院申雪峰/陈培华/孙坚原团队揭示癫痫患者致痫灶内的病理性谷氨酸释放特征
癫痫,作为最普遍的神经系统疾病之一,影响着全球约5200万人,造成沉重的社会与经济负担。癫痫的发病与致病灶内兴奋性/抑制性突触传递的功能失衡密切相关。虽然已知癫痫发作时细胞外谷氨酸浓度升高,但传统检测方法(如微透析)时间分辨率低(分钟级),无法捕捉到突触传递的基础——亚毫秒级的量子化释放。因此,表征患者癫痫致病灶内的量子化谷氨酸释放的病理特性,对于阐明人类大脑中癫痫发作的机制具有重要意义。
酶基电化学谷氨酸传感器为监测活体组织和细胞中的谷氨酸动力学提供了一种具有前景的替代方案,但以往的技术路线仍存在两大局限:响应速度慢(秒级),且制作成本高昂,难以广泛应用。
12月30日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院申雪峰/陈培华/孙坚原团队联合厦门弘爱医院姚一团队于Biosensors and Bioelectronics上发表最新研究,开发出了一种新型、快速、低成本的超快谷氨酸传感器,并利用该传感器首次在人类癫痫患者致病灶脑组织中,记录到了亚毫秒级的量子化谷氨酸释放事件,进一步揭示了癫痫病理状态下的兴奋/抑制失衡机制。

文章上线截图
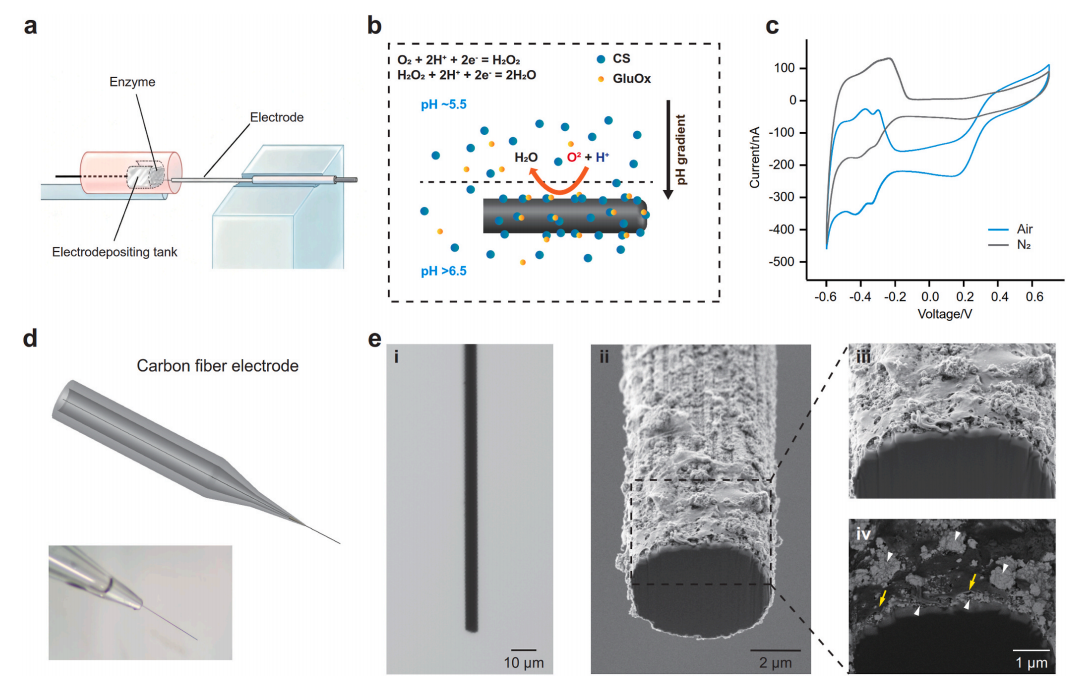
图1. 一种具有纳米级酶涂层的新型超快谷氨酸传感器的研发
通过体外电化学实验,团队证实该新型超快谷氨酸传感器对谷氨酸具有高灵敏度(检测限0.1μM)、宽线性范围(1-100μM)和良好的稳定性,标准响应时间仅约100ms,可实现20kHz采样频率。并在小鼠离体脑片上,成功记录到了海马CA1区域内的量子化谷氨酸释放信号(单峰信号),证实技术应用的可行性。
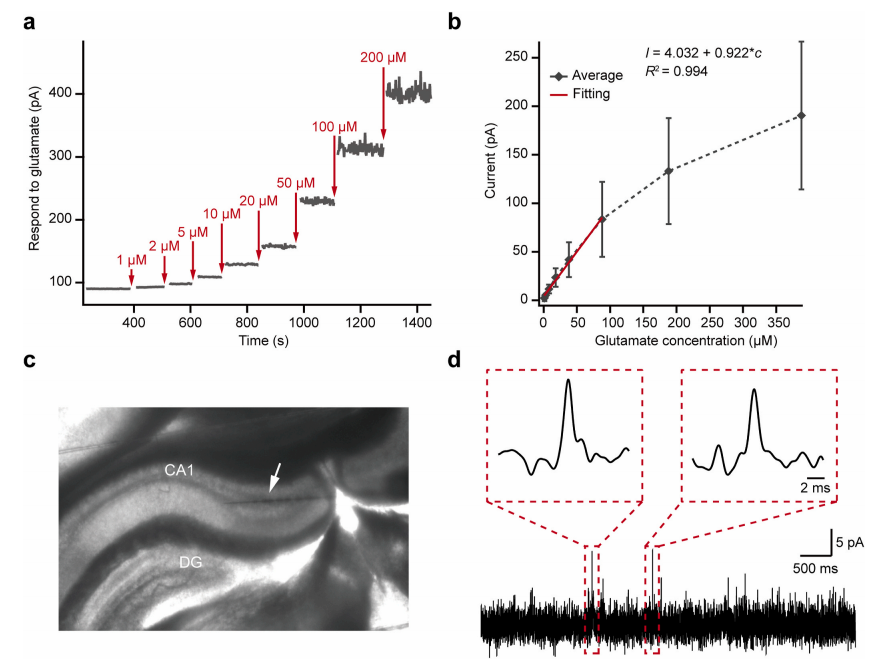
图2. 超快谷氨酸传感器的电化学表征
随后,研究人员将传感器应用于六名局灶性皮质发育不良(一种常见的药物难治性癫痫类型)患者的切除脑组织上,发现致病灶在受到刺激后,表现出比对照组区域更显著的强直性谷氨酸释放,证实了其存在严重的兴奋毒性环境。而重要的是,团队首次在人类脑组织中记录到量子化谷氨酸释放事件,且发现致病灶内的量子化释放事件幅度显著大于对照区域,且刺激后会出现更多大尺寸的释放事件。这表明癫痫灶内的谷氨酸能神经突触出现显著的功能异常,倾向于释放更多递质,从而造成癫痫病理状态下的兴奋/抑制失衡。
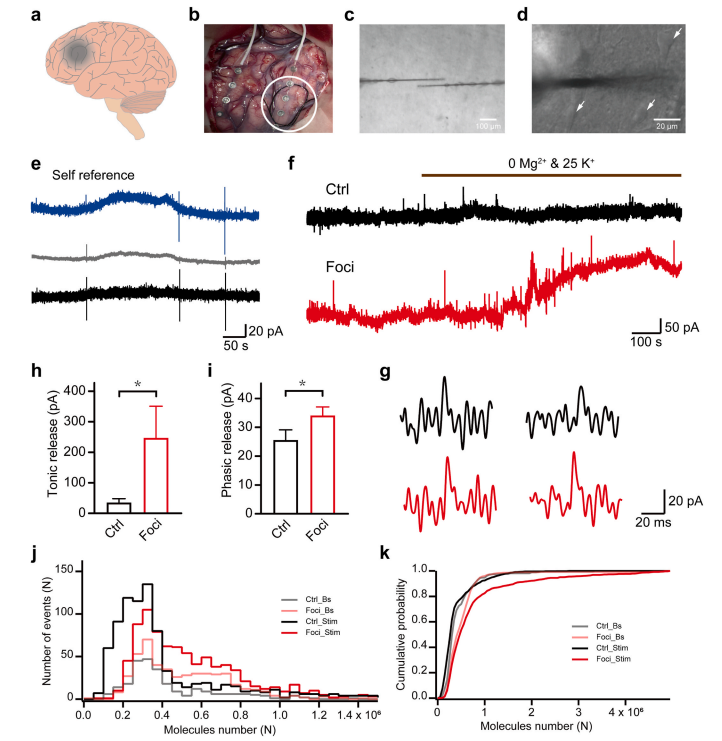
图3. 癫痫患者致痫组织中谷氨酸动力学的实时监测
综上,这一研究将癫痫的病理机制从网络层面直接关联到神经突触的量子化释放环节,为理解兴奋/抑制失衡提供了最直接的实验证据。而所开发的新型超快谷氨酸传感器也为研究神经系统疾病的突触水平机制提供了一个强大、实用且经济的平台。
深圳先进院助理研究员赵帅男、博士后李超与深圳理工大学博士后郑彦春是本项工作的共同第一作者,通讯作者为申雪峰副研究员、陈培华副研究员、孙坚原研究员、赵帅男博士,以及厦门弘爱医院的姚一主任医师。申雪峰团队长期专注新型神经电生理与电化学技术的研发,及其在(癫痫等)神经系统疾病研究领域中的应用。该项目受到科技部脑计划、深圳市医学研究专项、厦门市卫健委科技项目、国家自然科学基金、广东省自然科学基金、博士后基金等资助,感谢深港脑科学创新研究院以及深圳市脑解析与脑模拟重大科技基础设施对本研究提供的支持。
